カップリング反応(カップリングはんのう、英: coupling reaction)とは、2つの化学物質を選択的に結合させる反応のこと。特に、それぞれの物質が比較的大きな構造(ユニット)を持っているときに用いられることが多い。天然物の全合成などで多用される。
概要
結合する2つのユニットの構造が等しい場合はホモカップリング、異なる場合はクロス(交差)カップリング(またはヘテロカップリング)と言う。一般式としては以下のように表される:
- ホモカップリング:
- クロスカップリング:
カップリング反応として様々な方法が開発されている。近年は特に触媒量の遷移金属化合物の存在下で、有機金属化合物あるいは不飽和炭化水素化合物が有機ハロゲン化合物と縮合するカップリング反応がいろいろ知られてきている。従来の有機反応では実現できなかった、二重結合や三重結合を有する炭素同士の結合が実現できた点が画期的である、と評されている。信頼性が高い反応として、天然物合成などで多用されるようになった。また産業分野でも医薬品や農薬、液晶材料など幅広い分野で利用されている。
2010年のノーベル化学賞はこのカップリング反応のうち、ヘック反応・根岸カップリング・鈴木・宮浦カップリングの合成方法を確立した3者に授与された。
銅を用いたカップリング
ウルマン反応を代表とする、芳香族ハロゲン化物のハロゲン化銅を用いたホモカップリング反応。触媒反応ではなく、銅は試薬量が必要。
ウルマン反応
銅を用いた芳香族ハロゲン化物をビフェニル誘導体とするホモカップリング反応。系中でアリールハロゲン化銅が生成する。
- (触媒)
グレーサー反応
当量または触媒量の銅化合物を用いた末端アルキン(アセチレン)の酸化的ホモカップリング反応。
- (触媒)
パラジウムを用いたカップリング
ハロゲン化アリルまたはハロゲン化アリール等が π-パラジウム錯体を経由して触媒サイクルに導入されるクロスカップリング反応。収率は悪いがニッケル触媒でも同様な反応が進行する。
溝呂木・ヘック反応が元となり、ビニル-パラジウム錯体から、アリール-パラジウム錯体へと反応種が展開した。また金属-パラジウム間のカップリング基の交換反応の応用で、カップリングの対象となる官能基が広がった。1990年代後半からパラジウム触媒の配位子に関して研究が進み、かさ高く電子密度の高い配位子を用いることで反応性がはるかに向上することが明らかにされた。塩化アリールなど、従来は反応性が低く用いることができないとされていた基質も、近年では十分な効率でカップリング反応が行えるようになってきている。
溝呂木・ヘック反応
パラジウム触媒の存在下で有機ハロゲン化物と末端アルケンから内部アルケンやスチレン誘導体を生成する反応。日本では溝呂木・ヘック反応と呼ばれる場合もある。
- 触媒
根岸カップリング
有機亜鉛を用いるカップリング。
- 触媒
右田・小杉・スティルカップリング
有機スズを用いる。
- 触媒
薗頭カップリング
銅も用いてアルキンとの結合を作る反応。
- 触媒 塩基
檜山カップリング
基質として有機ケイ素化合物を用いるカップリング反応。フッ化物イオンによりケイ素化合物を活性化する必要がある。フッ化物イオンを必要としない、檜山・デンマークカップリングもある。
- 触媒
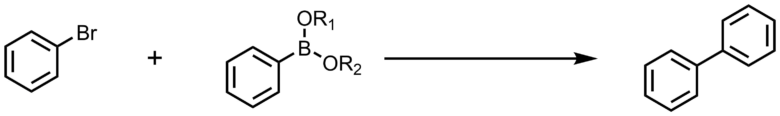
鈴木・宮浦カップリング
触媒に有機パラジウム化合物(無機パラジウムでも反応は進行する)、基質に有機ホウ素化合物を用いる。
- 原料が安定で扱いやすい
- 反応条件が穏和で操作が簡便
- 有害な廃棄物をほとんど出さない(生成物はカップリング生成物と通常ホウ酸)
など優れた特長を併せ持ち、実験室レベルから工業規模での合成まで広く応用されている、極めて重要な反応となっている。
- 触媒 塩基
バックワルド・ハートウィッグアミノ化反応
ハロゲン化アリールとアミンを反応させ、アリールアミンを作る反応。形式としては銅触媒を用いるウルマン反応と同じ反応となる。
- 触媒 塩基
ニッケルを用いたカップリング
ニッケルもパラジウムと同様な触媒サイクルの反応機構でカップリング反応を行なう。
熊田・玉尾・コリューカップリング
有機金属種として有機マグネシウム化合物(グリニャール試薬)を用い、触媒にはニッケルを用いる。同様の反応はパラジウム触媒でも進行する。最初に発見されたクロスカップリング反応であるとされる。
- 触媒
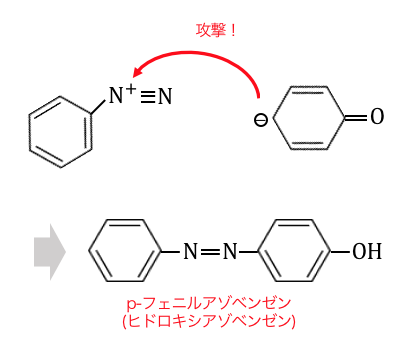
ジアゾカップリング
アゾ化合物を用いるカップリング反応。この反応は求電子置換反応であり、触媒反応ではない。
出典
関連文献
- 辻二郎「日進月歩のパラジウム, ニツケル触媒の化学 -増大する有機合成化学へのインパクト-」『有機合成化学協会誌』第59巻第6号、有機合成化学協会、2001年、607-616頁、doi:10.5059/yukigoseikyokaishi.59.607。
関連項目
- ロサルタン - クロスカップリング反応技術を利用した高血圧治療薬
外部リンク
- ニューロタン® - クロスカップリング反応技術を利用した高血圧治療薬
-768x403.jpg)